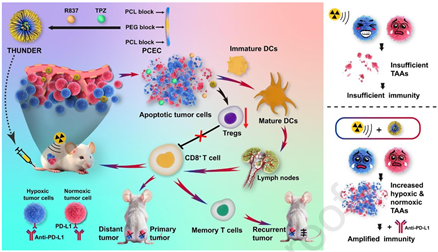
放疗引起的远端效应引起了研究者的广泛关注。然而,肿瘤乏氧相关的放射抵抗、免疫刺激不足和肿瘤微环境免疫抑制等因素导致该效应的临床表现并不显著。有鉴于此,四川大学巩长旸教授和刘磊教授构建了一种放疗-免疫调节纳米平台(THUNDER),其能够与RT产生协同作用,以触发乏氧和常氧肿瘤细胞源性肿瘤相关抗原(TAAs)的产生,从而可诱导显著的远端效应和持续的免疫记忆。
本文要点:
(1)THUNDER具有延长的血液循环和高效的肿瘤保留能力。与RT联合使用时,THUNDER可有效破坏乏氧和常氧肿瘤细胞,促使两种细胞大量释放TAAs,以进一步促进DCs成熟,产生强大的免疫刺激,启动全身抗肿瘤免疫。在小鼠模型中,THUNDER和RT的联合可有效抑制三阴性乳腺癌的生长。
(2)进一步联合PD-L1阻断疗法后,该策略可显著抑制肿瘤的远端转移和复发,导致远端肿瘤内的CD8+ T淋巴细胞增加5.2倍,脾脏中的效应记忆T细胞增加2.8倍。综上所述,该研究开发的放疗-免疫调节纳米平台可通过诱导乏氧和常氧TAAs有效对抗肿瘤转移和复发,为放射-免疫治疗开辟了一条新的途径。
Jie Li. et al. Radiotherapy-immunomodulated nanoplatform triggers both hypoxic and normoxic tumor associated antigens generation for robust abscopal effect and sustained immune memory. Biomaterials. 2024
https://www.sciencedirect.com/science/article/pii/S0142961224005416



















