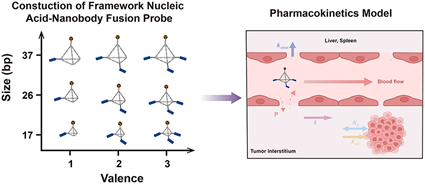
纳米抗体具有优异的抗原识别作用和肿瘤靶向性,其在免疫PET成像领域中具有广阔的应用前景。然而,快速清除等问题仍会导致其肿瘤积累效率受限。多聚化和白蛋白结合策略可以延长纳米抗体的循环时间,并提高其肿瘤靶向性。因此,研究者亟需开发一种简单、通用的方法来构建蛋白多聚体。有鉴于此,上海交通大学谭蔚泓院士、Ding Ding和湖南大学吕一帆教授利用DNA纳米技术的易合成、尺寸可控和精确组装等优势构建了具有多价和多尺寸、靶向CD47的框架核酸-纳米抗体融合探针。
本文要点:
(1)在完成结构表征后,研究者在结直肠癌LS174T小鼠模型中进行了体外特异性评估和体内PET/CT成像分析。此外,研究者也建立了一个药代动力学模型,并进行了大量体内数据拟合以证明该模型的合理性,随后也测试了改变不同药代动力学参数对肿瘤摄取预测的影响。
(2)实验结果表明,研究者可通过控制核酸支架的大小和附着的纳米抗体的数量来精准地调节探针在肿瘤部位的积累。综上所述,该研究不仅开发了一种用于构建纳米体多聚体的有效策略,而且也构建了药代动力学模型,其能够为设计具有可预测递送效率的成像探针提供了新的见解。
Yani Yang. et al. Framework Nucleic Acid-Nanobody Fusion Probe-Based Pharmacokinetics Modulation and Analysis for Efficient Positron Emission Tomography Imaging. ACS Nano. 2024
DOI: 10.1021/acsnano.4c09127
https://pubs.acs.org/doi/10.1021/acsnano.4c09127



















