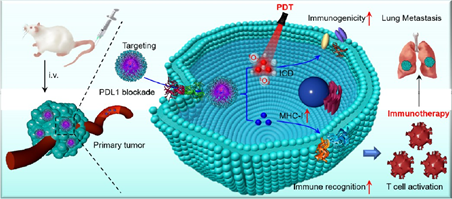
肿瘤特异性细胞毒性T细胞免疫非常依赖于有效的抗原呈递和持续的信号转导。然而,这种免疫反应往往会受到乳腺癌固有的低免疫原性和主要组织相容性复合体I类(MHC-I)表达不足等问题的影响。有鉴于此,广州医科大学李仕颖研究员和余睿教授制备了一种能够增强细胞毒性T细胞应答的嵌合肽工程化聚合前药(PDPP),其特点是具有较高的载药量和精准的药物化学计量比,并且其中的免疫原性细胞死亡(ICD)诱导剂原卟啉IX(PpIX)和表观遗传药物地西他滨(DAC)被缩合为聚合前药PpIX-DAC。
本文要点:
(1)实验利用偶联了程序性死亡配体1(PD-L1)靶向肽序列(CVRARTR)的DSPE-PEG2000-Mal包封PpIX-DAC,以增强乳腺癌靶向药物递送。研究发现,PDPP可通过光动力疗法(PDT)消融乳腺癌细胞,并同时诱导损伤相关分子模式(DAMPs)的释放,以增强肿瘤免疫原性。
(2)此外,PDPP也可通过表观遗传调节上调MHC-I的表达,协同增强细胞毒性T细胞应答和PD-L1阻断。实验结果表明,PDPP能够诱导强大的抗肿瘤T细胞免疫,有效根除原发性和转移性乳腺癌。综上所述,该研究工作能够为化学计量纳米药物的开发和临床转化提供新的借鉴和参考。
Ying Chen. et al. Chimeric Peptide-Engineered Polyprodrug Enhances Cytotoxic T Cell Response by Inducing Immunogenic Cell Death and Upregulating Major Histocompatibility Complex Class I. ACS Nano. 2025
DOI: 10.1021/acsnano.4c12197
https://pubs.acs.org/doi/10.1021/acsnano.4c12197



















