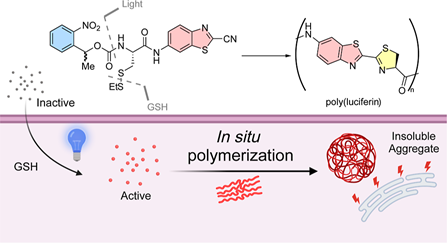
错误折叠蛋白的积累会影响细胞蛋白质稳态,并且与衰老和慢性疾病有关。此外,癌细胞也面临着基础蛋白质毒性应激水平升高的状况。加剧内质网(ER)应激已被证明能够诱导程序性细胞死亡,并同时增强抗癌免疫原性。疏水非生物大分子可以引发类似的应激反应。然而,大多数聚合物和纳米颗粒在发生内吞作用后会被隔离在核内体/溶酶体中,导致它们与蛋白质稳态体系之间的相互作用受阻。有鉴于此,斯坦福大学饶江宏教授采用原位聚合的方法,在细胞中合成了细胞渗透性单体的聚合物。
本文要点:
(1)实验利用L-半胱氨酸和2-氰基苯并噻唑(CBT)之间的光化学控制生物相容性缩聚构建了不溶性聚荧光素聚集体。研究发现,原位聚合可激活未折叠蛋白反应的BiP-PERK-CHOP通路,并且内质网应激能够启动一种与副凋亡相一致的调节性细胞死亡形式。
(2)此外,垂死的细胞能够产生损伤相关分子模式(DAMPs),表明免疫原性细胞死亡可增强抗肿瘤免疫。综上所述,该研究证明了原位聚合能够模拟错误折叠的蛋白质聚集以诱导蛋白质毒性应激和癌细胞死亡,从而提供了一种利用癌症脆弱性的新型治疗策略。
DOI: 10.1021/jacs.4c15644
https://pubs.acs.org/doi/10.1021/jacs.4c15644



















