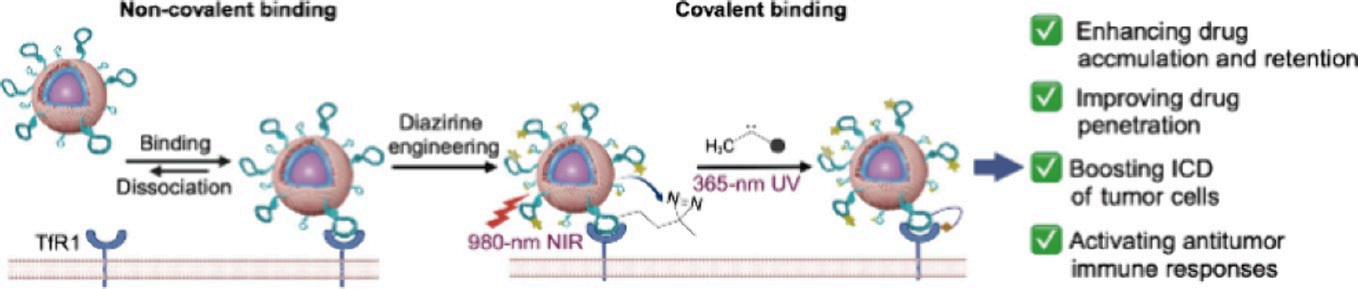
特异性地提高小分子化疗药物的瘤内积累和保留以实现治疗效果的最大化是一项严峻的挑战。有鉴于此,湖南大学赵子龙教授、刘艳岚教授和谭蔚泓院士在聚乙二醇化、磷脂包被的上转换纳米颗粒上安装双吖丙啶标记的转铁蛋白受体1(TfR1)靶向适配体,并负载阿霉素,构建了近红外(NIR)激活的靶向共价纳米药物。
本文要点:
(1)在980 nm近红外光照射下,该靶向共价纳米药物可识别癌细胞上的TfR1,并与其发生共价交联。研究发现,静脉注射6小时和120小时后,该药物在肿瘤内的阿霉素积累量分别比基于适配体的靶向纳米药物高6倍和5.5倍。得益于较高的药物递送效率,该靶向共价纳米药物可促进阿霉素诱导的免疫原性细胞死亡,激活抗肿瘤免疫应答,缩小原发肿瘤和远端肿瘤的大小,
(2)在具有免疫抑制微环境的4T1同系乳腺肿瘤模型中,该靶向共价纳米药物能够表现出比靶向纳米药物和市售Doxil更好的治疗效果和更低的不良反应。综上所述,该研究开发的靶向共价纳米药物结合了分子识别的特异性、双吖丙啶的响应性和光调控纳米药物的准确性等优势,有望为增强化疗药物的抗癌疗效提供一种有效的新策略。
Zhijia Zhu. et al. Targeted Covalent Nanodrugs Reinvigorate Antitumor Immunity and Kill Tumors via Improving Intratumoral Accumulation and Retention of Doxorubicin. ACS Nano. 2024
DOI: 10.1021/acsnano.4c12447
https://pubs.acs.org/doi/10.1021/acsnano.4c12447



















