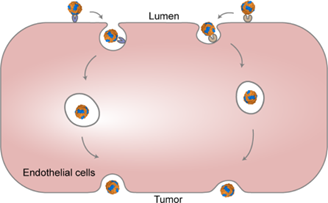
血管在药物的全身递送过程中具有屏障作用,由此导致设计双靶向纳米药物以提高其肿瘤递送效能成为了一项严峻的挑战。如何实现有效的跨内皮细胞运输是一个重要的研究课题。有鉴于此,南开大学庄洁教授和黄兴禄教授报道了一种基于合成生物学、用于设计双靶向铁蛋白纳米笼(Dt-FTn)的方法,以探究受体介导的跨肿瘤内皮细胞运输过程。
本文要点:
(1)实验利用基因工程化逻辑门控策略在大肠杆菌中共组装了多种具有可调节的RGD靶向配体和固有TfR1靶向配体比例的Dt-FTn。这些Dt-FTn可用于研究在低渗透性肿瘤中受体介导的血管渗透性与双靶向纳米药物之间的相互作用。基于机器学习的单血管分析结果显示,双受体表达谱会显著影响双靶向纳米药物在低渗透性肿瘤中的血管运输过程。
(2)在患者源性结肠癌模型中,该纳米药物的双配体最佳比例可以根据肿瘤细胞的受体表达谱实现定制。综上所述,该研究能够为合理设计用于肿瘤靶向递送的双靶向纳米药物提供新的见解和指导。
Mingsheng Zhu. et al. Rational Design of Dual-Targeted Nanomedicines for Enhanced Vascular Permeability in Low-Permeability Tumors. ACS Nano. 2025
DOI: 10.1021/acsnano.4c12808
https://pubs.acs.org/doi/10.1021/acsnano.4c12808



















