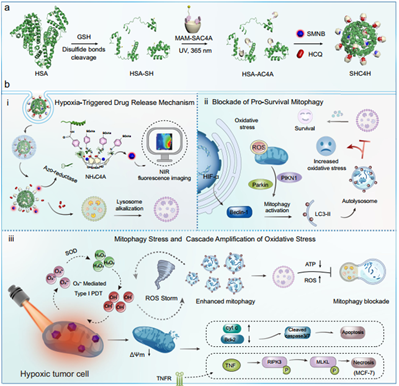
乏氧肿瘤具有适应低氧环境的能力,这种能力可支持肿瘤的生存和产生治疗抗性,因此成为了癌症治疗面临的一项严峻挑战。增强的线粒体自噬(通过自噬选择性降解线粒体)是帮助维持乏氧肿瘤细胞稳态的重要机制。有鉴于此,中山大学Hongzhong Chen、曾小伟教授和南开大学郭东升教授开发了偶氮杯[4]芳烃修饰的超分子白蛋白纳米颗粒,其可共递送羟氯喹和线粒体靶向光敏剂,进而能够通过调节线粒体自噬诱导级联氧化应激,以治疗乏氧肿瘤。
本文要点:
(1)这些纳米颗粒能够响应乏氧,并在乏氧的肿瘤细胞中释放负载的客体分子。研究发现,释放的羟氯喹可破坏线粒体自噬过程,从而增加氧化应激,并进一步削弱肿瘤细胞。在激光照射下,光敏剂能够产生不依赖于氧气的活性氧,以诱导线粒体损伤和线粒体自噬激活。
(2)实验结果表明,同步的时空自噬激活和自噬通量阻断的双重作用能够实现增强的自噬和氧化应激,最终导致肿瘤细胞死亡。综上所述,该研究证明了将羟氯喹介导的线粒体自噬阻断与线粒体靶向光敏剂进行联合能够级联放大氧化应激,以实现对乏氧肿瘤的有效治疗。
Wenyan Wang. et al. Engineered hypoxia-responsive albumin nanoparticles mediating mitophagy regulation for cancer therapy. Nature Communications. 2025
https://www.nature.com/articles/s41467-025-55905-y



















