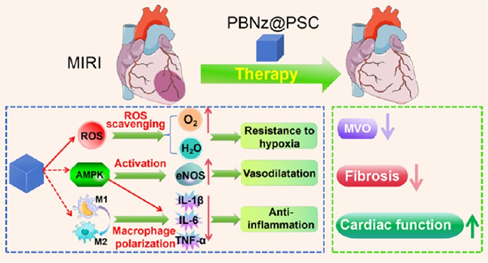
心肌梗死(MI)后的血流恢复会破坏缺血区域的生理和代谢平衡,进而导致继发性损伤,该过程被称为心肌缺血再灌注损伤(MIRI)。活性氧物种(ROS)的产生和炎症反应是造成MIRI的主要原因。目前的MIRI治疗策略主要集中在清除ROS和抗炎等方面,对MIRI的缓解作用较为有限。普鲁士蓝纳米酶(PBNz)具有多种类酶活性,包括过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)等,能够有效清除ROS和对抗炎症。为了提高PBNz治疗MIRI的有效性、生物相容性和安全性,南京大学顾宁院士、徐标教授和东南大学何泓良教授开发了一种聚葡萄糖-山梨醇羧甲基醚包被的PBNz制剂(PBNz@PSC)。
本文要点:
(1)PBNz@PSC不仅能够表现出增强的类SOD活性,而且可以通过EPR效应被动靶向受损的心肌。体内外研究结果显示,PBNz@PSC具有良好的生物相容性、安全性、ROS清除作用以及驱动巨噬细胞从M1向M2极化的能力,从而能够降低IL-1β、IL-6和TNF-α水平,以对抗炎症。研究发现,PBNz@PSC可以逆转缺血再灌注诱导的心肌损伤,减轻冠状动脉微血管阻塞(MVO),改善心肌重构和心脏功能。
(2)实验结果表明,PBNz@PSC对MIRI的治疗效果比临床药物丹参酮IIA磺酸钠更加显著。研究者也进一步揭示了PBNz@PSC治疗MIRI的潜在机制(即介导AMPK的激活)。综上所述,该研究开发了一种用于治疗MIRI的新策略,有望能够显著改善缺血再灌注的临床结果。
Mengmeng Long. et al. Prussian Blue Nanozyme Featuring Enhanced Superoxide Dismutase-like Activity for Myocardial Ischemia Reperfusion Injury Treatment. ACS Nano. 2025
DOI: 10.1021/acsnano.4c14445
https://pubs.acs.org/doi/10.1021/acsnano.4c14445



















