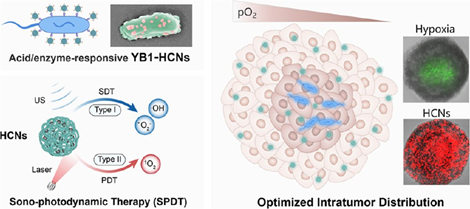
“活体治疗载体”为癌症研究开辟了一条新的途径。然而,由于肿瘤微环境存在异质性,因此如何在整个实体瘤中实现有效载荷的均匀、持久分布仍是一项极具挑战性的难题。有鉴于此,中国科学院深圳先进技术研究院蔡林涛研究员、李文杰研究员和刘陈立研究员通过将酸/酶触发的可分离纳米颗粒(HCNs)负载在代谢寡糖工程化溶瘤菌YB1表面,构建了一种活体药物生物杂化体(YB1-HCNs)。
本文要点:
(1)在细菌乏氧导航穿透肿瘤的过程中,YB1−HCNs能够响应性地持续释放HCNs,使载药制剂在整个肿瘤中均匀分布。在激光和超声(US)的连续照射下,HCNs可分别产生II型和I型ROS,以实现性能优异的声-光动力治疗(SPDT),并且能够通过HCNs与YB1的协同作用在肿瘤的浅表常氧区和深部乏氧区产生良好的治疗效果。
(2)单次给药后,该组合可实现98.3%的原发肿瘤抑制率,使小鼠存活时间延长90天(无复发),并且能够进一步诱导产生强大的免疫记忆效应,以完全抑制治愈小鼠的肿瘤再挑战。综上所述,该研究开发的细菌杂化载体能够优化YB1和HCNs的空间分布,为实现治疗效果的最大化和激发持久的抗肿瘤免疫提供了一种新的策略。
Xu Zhang. et al. Nanobiohybrid Oncolytic Bacteria with Optimized Intratumoral Distribution for Combined Sono-Photodynamic/ Immunotherapy. ACS Nano. 2025
DOI: 10.1021/acsnano.4c16740
https://pubs.acs.org/doi/10.1021/acsnano.4c16740



















